省流版,来自Roman Valiulin的非常精彩的总结。
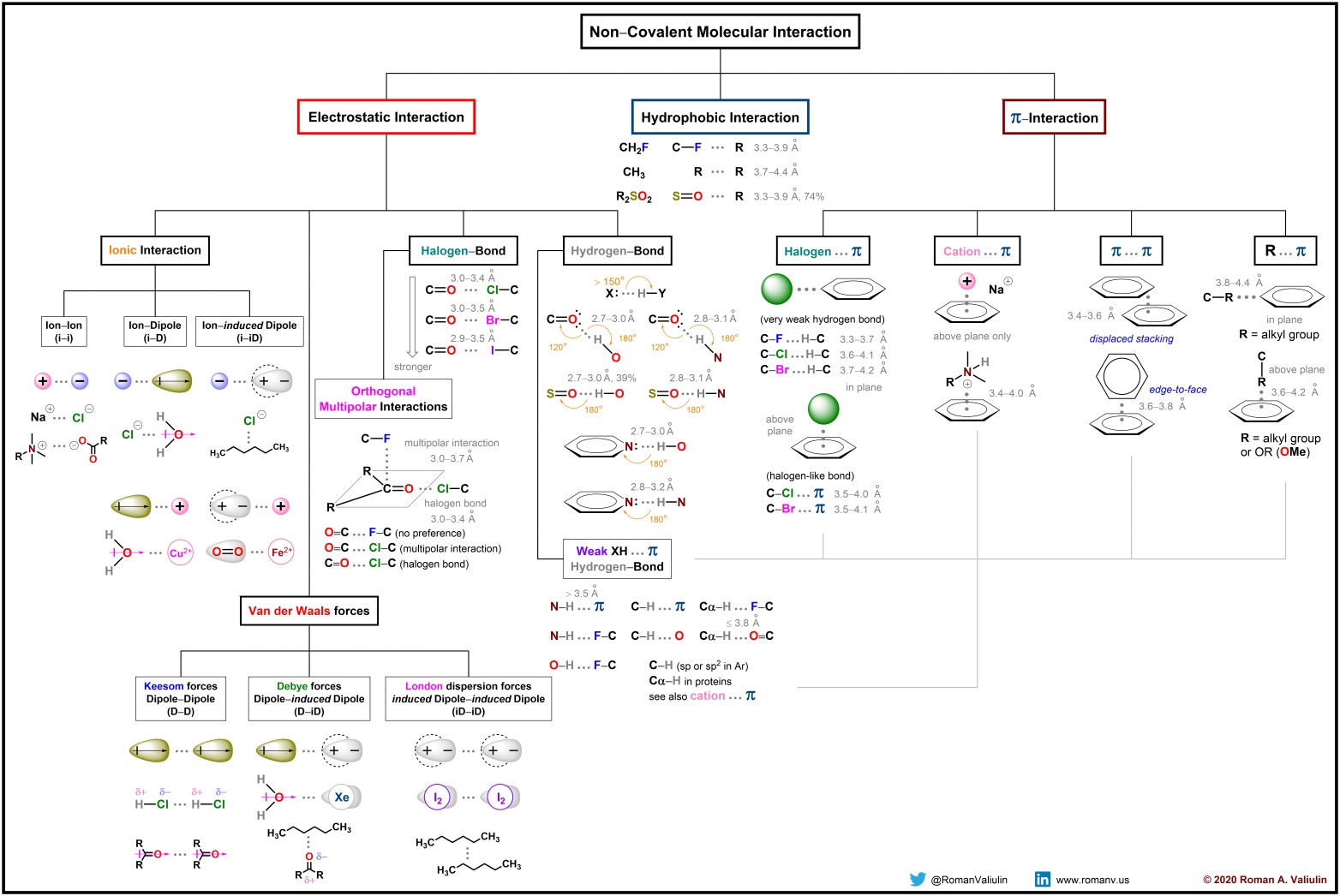
共价单键的强度通常在 80 – 100 Kcal/mol的范围内,实际结构分析中更多涉及到的是非共价相互作用力。非共价相互作用可分为离子键(~2 Kcal/mol)、氢键(~1 Kcal/mol)、π相互作用(~1 – 3 Kcal/mol)、疏水相互作用(~0.7 Kcal/mol)、范德华力等。
非共价相互作用对于维持大分子(如蛋白质和核酸)的三维结构至关重要,它们还参与许多生物过程,这些相互作用也深刻影响了药物设计。
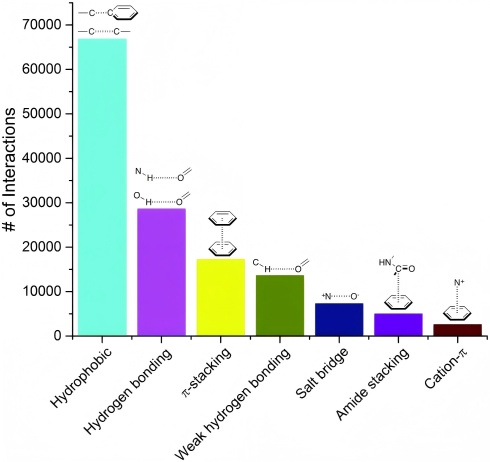
Matthieu Schapira等人统计了超过 11000 种复合物的配体-蛋白相互作用,将 7 种最常见的相互作用类型进行分类,疏水相互作用和氢键是最多的相互作用。
离子键
离子键(Ionic bond),也叫盐桥(Salt bridge),一般是两种带相反电荷的原子间形成的相互作用,距离一般在2.5到3Å左右。许多蛋白质的三维结构是由内部的盐桥所维持的,其中许多都位于蛋白质的核心区域,具有高度的稳定性。在很多情况下,盐桥实际上是由氢键和离子相互作用共同构成的。
一个比较常见的例子是带正电的胺基和天冬氨酸残基侧链形成的作用,20种常见氨基酸中带正电的有Lys、Arg、Gln、Asn、His,带负电的有Glu、Asp。因此常见的盐桥一般在Lys、Arg、His的N和Asp、Glu的羧基氧之间形成。
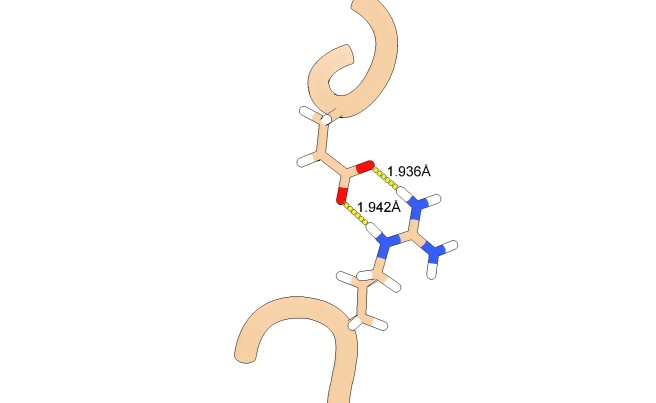
比如在人类唾液淀粉酶(PDB 1SMD)中,由Glu27和Arg387形成的盐桥。Glu27 的侧链带电羧酸氧原子与Arg387的胍基侧链带正电的氮原子形成了两个非常强的氢键,此外还有可能存在额外较弱的交叉氢键来增加稳定性。
氢键
氢键是生物大分子中最常见的非共价相互作用之一,是部分带正电的氢原子和部分/完全带负电的氧、氮、硫或氟原子形成的相互作用。
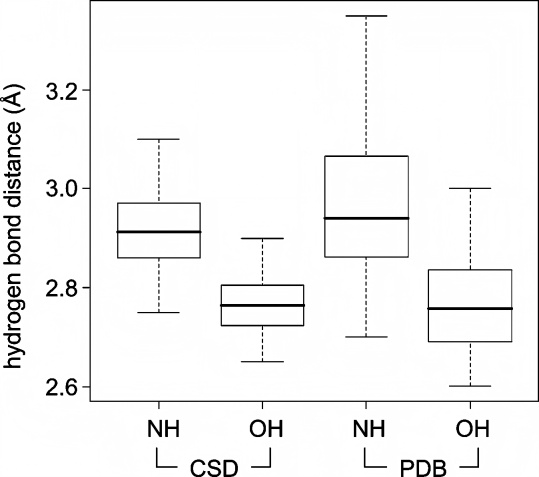
Martin Stahl等人根据PDB数据库和CSD数据库的结构数据统计,氢键的长度大多在2.6Å到3.1Å之间。PDB数据库Validate的标准检测下限是2.2Å,超过2.2Å被认为是clash。
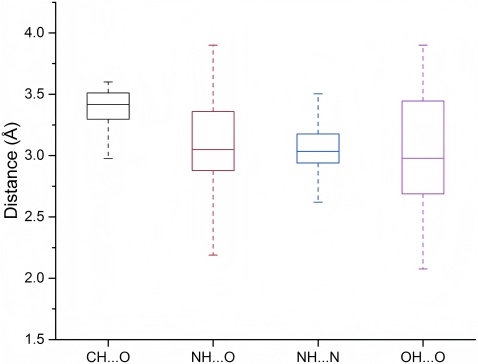
Matthieu Schapira等人对不同类型的氢键距离进行了统计和计算,包括了弱氢键(CH…O)和强氢键(NH…O,NH…N,OH…O)。
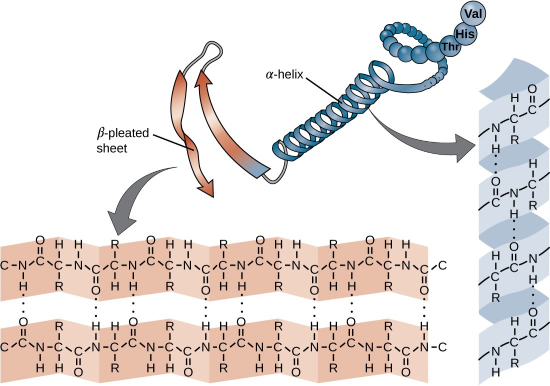
蛋白质中最常见的氢键是稳定二级结构的α螺旋和β折叠之间的氢键 :
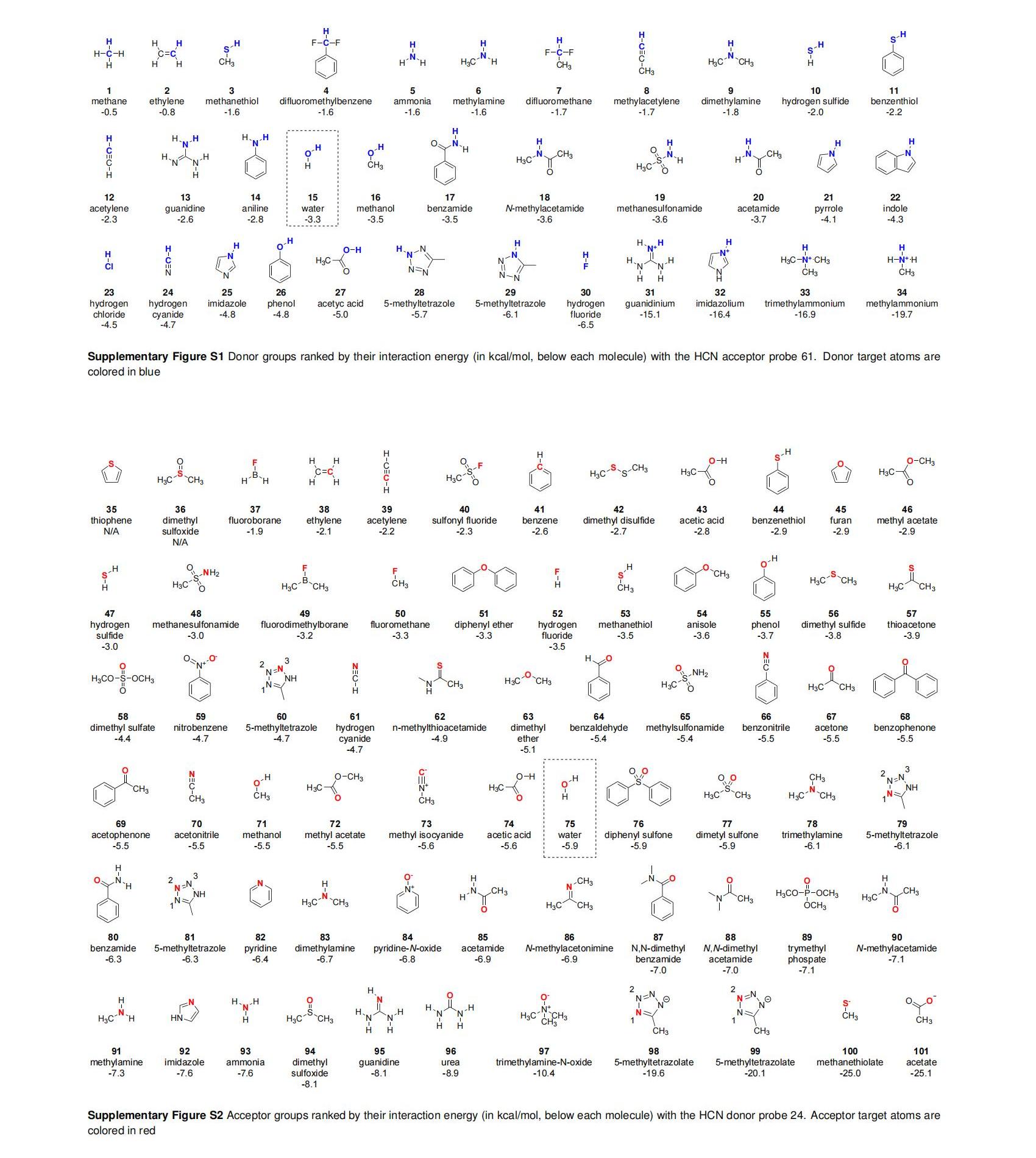
Diogo Santos-Martins和Stefano Forli对34个供体和67个受体的氢键基团进行研究,给出了详尽的氢键供体/受体类型及其作用力强度排行(以HCN为受体/供体),并发现其强度和方向性无明显关联。
π相互作用
π-π相互作用
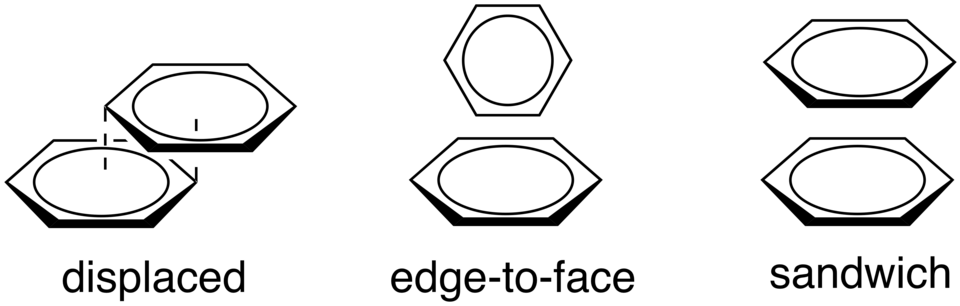
芳香环之间的π相互作用有很多的文献报道,T 形的边对面排列(face to face)和平行位移的堆积排列(edge to face)较为常见,π向互作用是由范德华力扩散和静电作用共同构成的,这种相互作用的精确性质尚不清楚,分子建模软件可能无法准确模拟,这两种排列的能量相似,为 -1.6 至 -2.4 Kcal/mol。
在蛋白质中,平行位移的堆积排列更为常见,苯丙氨酸和酪氨酸形成的π相互作用占多数。
除了两个芳基之间的相互作用外,芳基与蛋白质酰胺主链的π面之间也存在相互作用,包括一系列 五元和六元的杂环化合物,Andrea N. Bootsma和Prof. Steven E. Wheeler对此进行了系统性的研究,杂环的取向方式是使得杂环偶极矩和酰胺偶极矩接近反平行。
π-阳离子相互作用
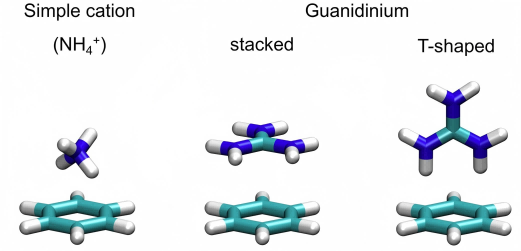
阳离子-π相互作用是富电子π体系(如苯、乙烯)表面与相邻阳离子之间的非共价分子相互作用。在蛋白质中,这个阳离子常常是赖氨酸和精氨酸,一般来说,精氨酸的相互作用比赖氨酸更频繁,色氨酸提供芳香相互作用的频率高于苯丙氨酸或酪氨酸。
此外,当甲基与一个电负性原子结合时,也可能会与芳香环的表面发生相互作用。带正电的氮原子是一种特别强的电负性取代基,因此,烷基化铵基团与芳香环的直接相互作用会在 3.4 – 4.0 Å的距离处产生强烈的吸引力。
在蛋白中一个常见的例子就是精氨酸的胍基和芳香环的相互作用,例如在乙酰胆碱酯酶和乙酰胆碱的结构中,乙酰胆碱的四价铵基团通过与一个色氨酸的阳离子-芳基相互作用而得到稳定,氮上的氢通过氢键相互作用提供额外的稳定性。
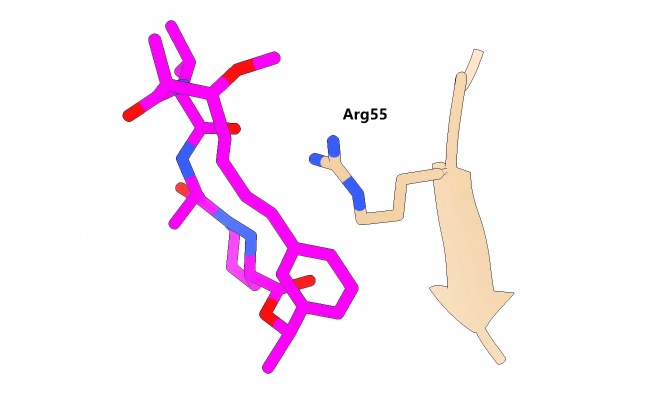
PDB 5TA4,化合物的苯基和Arg55形成了π堆积相互作用。
π-阴离子相互作用
阴离子-π相互作用与阳离子-π相互作用非常相似,阴离子位于贫电子π体系之上,通常由共轭分子上存在吸电子取代基而建立。π-阴离子相互作用此前一直被忽视,主要是因为其与直觉相悖的性质,但仍有一些此类相互作用的例子。
Brandi L. Schottel等人对此类相互作用进行了综述,其中列举了相关例子以及化学理论基础,表明这些结合相互作用的能量与氢键相当。
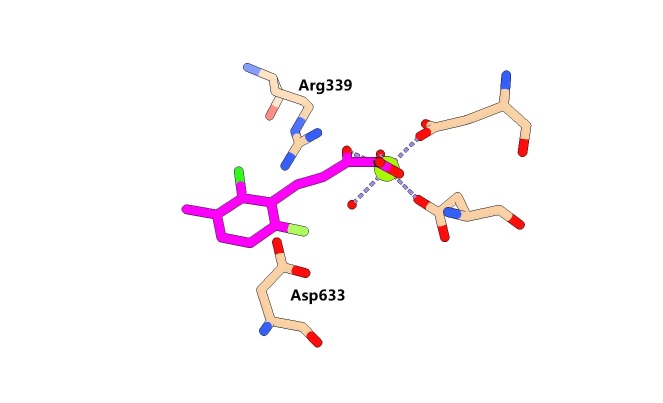
例如结核分枝杆菌苹果酸合酶与小分子苯基二酮酸的结合(PDB 3SB0),二酮酸与活性位点的镁离子和Arg339结合,而作为羧酸部分的Asp633残基的羧酸部分则面对面地紧贴着芳香环的π云区域,平均接触距离约为3.5Å,小于疏水性相互作用的典型约4.5埃的距离,表明存在阴离子-π相互作用。对这种相互作用的建模已被用于筛选小分子()。
卤素键
卤素键是一种类似氢键的相互作用,与氢键相比,卤素原子替代部分带正电的氢作为亲电基团,并与亲核或富电子基团形成弱静电相互作用。这些相互作用中的亲核试剂往往是高度电负性的(如氧、氮或硫),或者是阴离子。与卤-芳相互作用区别,卤-芳相互作用中富电子芳香基π云作为亲核基团,而卤素成键仅限于单原子亲核试剂。
根据《药理学指南数据库》卤素元素存在于约25%的药物中。虽然引入卤素元素可能是为了改善分子的吸收、分布、代谢特性,但卤素元素在选择性和结合亲和力方面也发挥着重要作用,并且通常会被用作与氢、甲基、羟基和氨基具有类似作用的取代基。
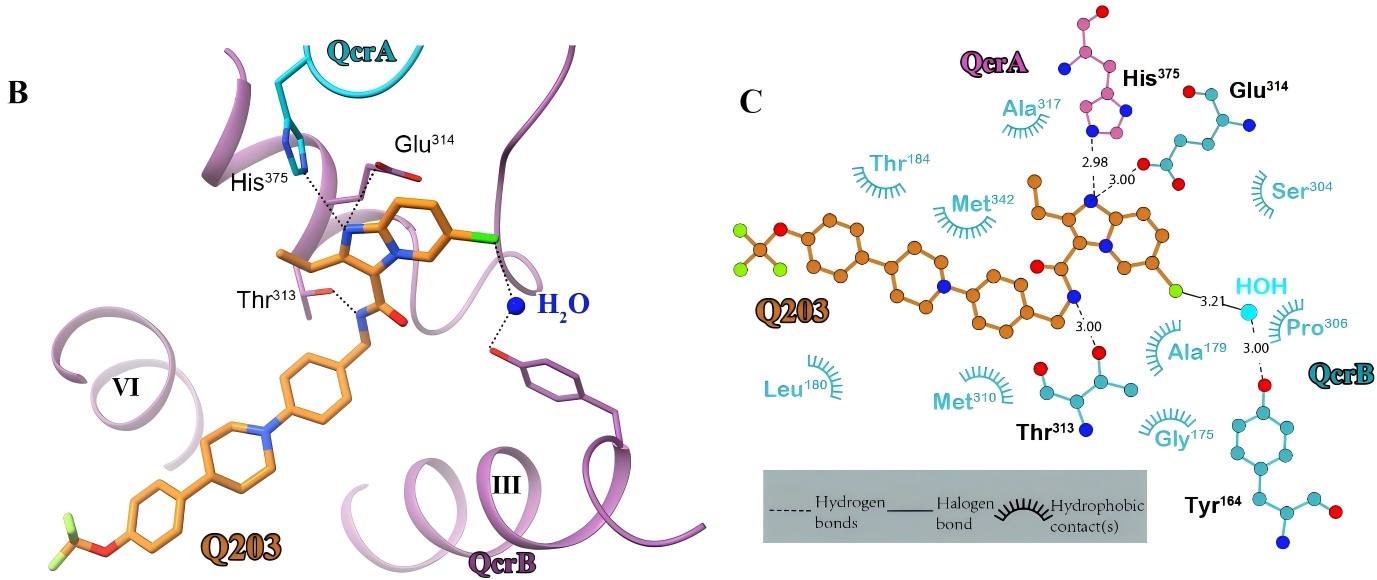
比如在结核分枝杆菌呼吸链复合物III及其靶向药物Q203的复合物结构(PBD 7E1W)中,Q203的氯原子通过与一个水分子的氢键形成桥梁,与QcrB亚基Tyr164相互作用稳定。
疏水相互作用
疏水相互作用是具有亲脂性的类似烃类的基团在水性介质中形成分子间聚集物的趋势,以及类似的分子内相互作用,一般在4.5Å左右。它没有其他相互作用中明确的键相互作用,常见的疏水相互作用就是脂肪族或芳香族侧链或基团彼此靠近形成疏水口袋。
亮氨酸Leu、缬氨酸Val、异亮氨酸Ile和丙氨酸Ala的侧链是最常参与疏水相互作用的。
但同时,许多脱靶效应,如与HERG、CYP等的相互作用、转运蛋白等,都与亲脂性有很大关系。
氨基酸相互作用
这是生物大分子中最广泛存在的相互作用,蛋白质靠着氨基酸相互作用形成高级结构。
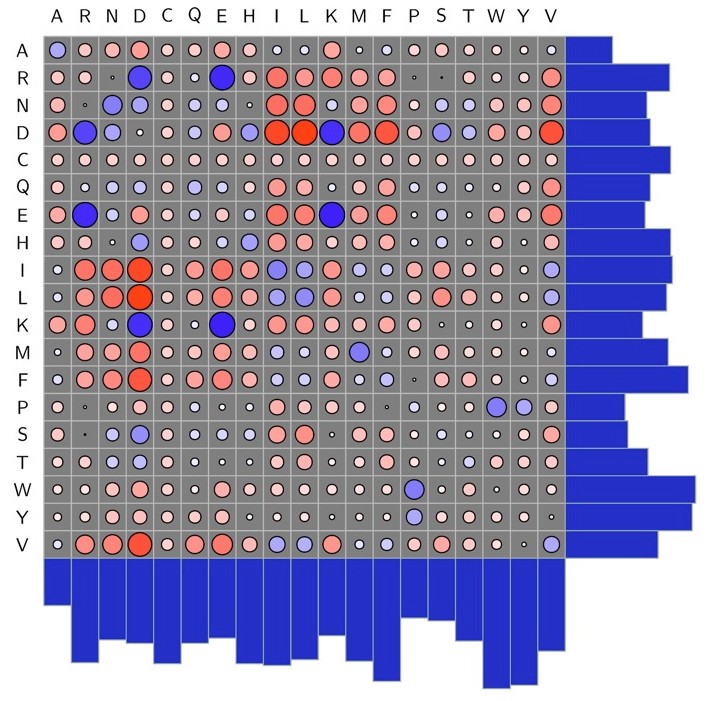
Andrew White等人系统地统计了每种氨基酸类型之间相互作用的数量,将这些数量转化为相互作用的能量。下面的图表展示了天然氨基酸的矩阵,较大的蓝色圆圈表示较强的相互作用。
配位键
配位键是一种特殊的键,介于共价键和离子键之间,它是由一个原子提供孤对电子,另一个原子提供空轨道而形成的键,键长通常在1.8到2.8Å左右,是一个比较强的相互作用,仅次于共价键。
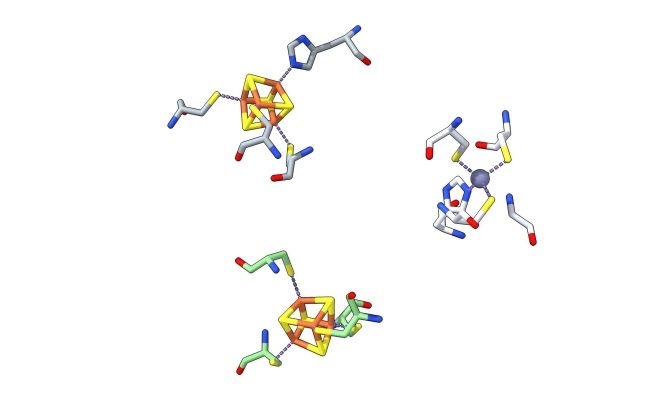
配位键经常是和金属离子的相互作用,比如血红素中Fe与Cys/His/Met的配位、铁硫簇中Fe与Cys/His/Met的配位、锌指结构中Zn的配位、聚合酶催化位点Mg的配位。
比如鼠呼吸链复合物I(PDB 8OM1)中的N5铁硫簇中的His/Fe配位、N6a铁硫簇的Cys/Fe配位以及ZN/Cys/His配位。
其他的相互作用
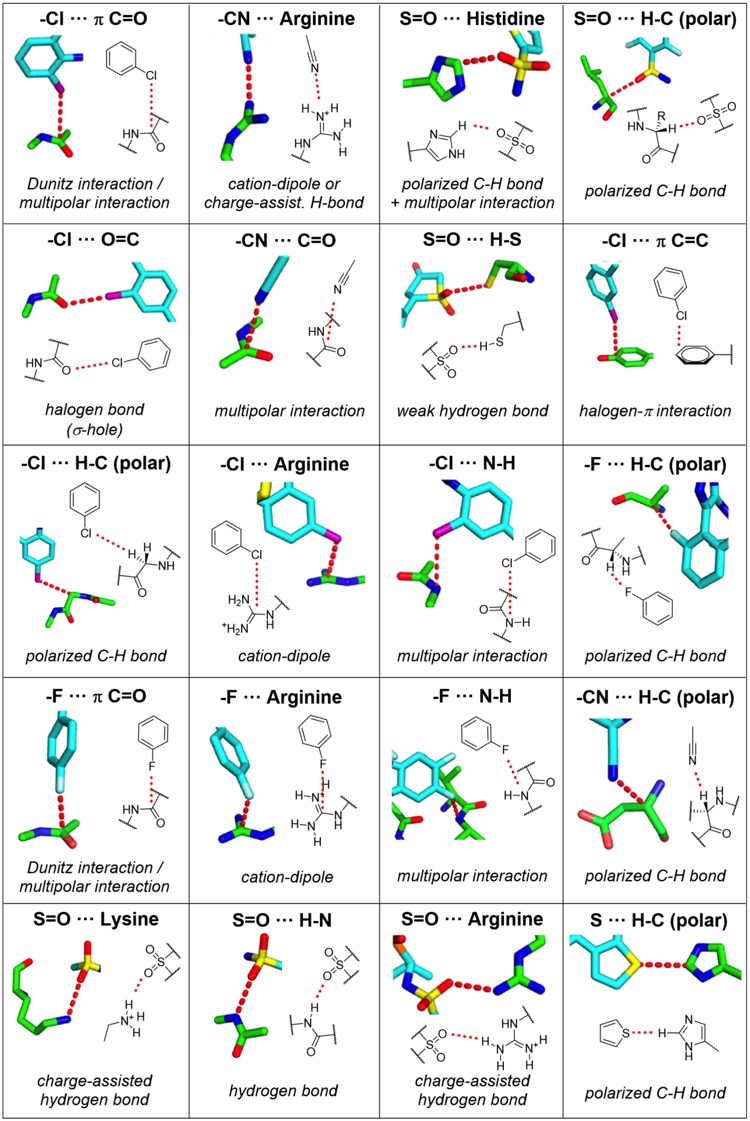
一些其他的相互作用,其中包括弱氢键,氢键的供体或受体并非氧或氮原子,而是极化的碳氢基团、连接碳的卤素原子或者电子 π 体系。
在Dennis Hu的Drug Hunter网站提供了这类相互作用详细描述。
参考文献
[1]
[2]
[3]
[4]
[5]
[6]
[7]
[8]
[9]
[10]
[11]